Móltömeg a nitrogén (N), és példák a általános képletű
Az arány a tömeg (m) egy anyag annak számát (n) nevezzük móltömege anyagok.
A moláris tömeg általában kifejezve g / mol, legalább kg / kmol. Mivel egy mól bármely anyag tartalmazza ugyanazt az egységek száma, a móltömeg egy anyag arányos a tömeg a megfelelő szerkezeti egységeket, azaz relatív atomtömeg az anyag (Mr):
ahol κ - tényező az arányosság ugyanaz minden anyagot. A relatív molekulatömeg - egy dimenzió nélküli mennyiség. Számítása relatív atomtömege kémiai elemek a periódusos rendszerben DI Mengyelejev.
A relatív atomtömeg egyenlő a atomos nitrogén 14,0067 amu A relatív molekulatömege egyenlő 14,0064 moláris tömege:
M (n) = úr (N) × 1 mol = 14,0067 g / mol.
Ismeretes, hogy a nitrogén kétatomos molekula - N2. Ezután, relatív atomtömeg nitrogén molekula egyenlő:
Ar (N2) = 14,0067 × 2 = 28,0134 amu
Relatív molekulatömege nitrogén molekula egyenlő 28,0134 moláris tömege:
M (N2) = úr (N2) × 1 = 28,0134 mol g / mol, vagy csak 28 g / mol.
Nitrogén színtelen gáz, nem rendelkezik sem a szag sem íz (atomi szerkezetének ábrán látható diagram. 1.), gyengén oldódik vízben és más oldószerekben nagyon alacsony olvadáspontú (-210 ° C), és forráspontja (-195,8 o C).
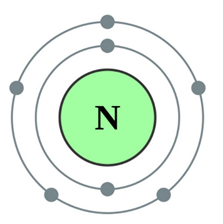
Ábra. 1. Szerkezet a nitrogénatom.
A molekulatömeg az anyag gáz halmazállapotú lehet meghatározni fogalmát használva annak moláris térfogata. Ahhoz, hogy megtalálja ebben a kötetben elfoglalt normál körülmények között egy bizonyos anyag tömege, majd kiszámítja a súlya 22,4 liter ez az anyag azonos körülmények között.
E cél elérése érdekében (számítása moláris tömeg) használhatják az ideális gáztörvény (Mengyelejev-Clapeyron egyenlet):
ahol p - Gáz nyomás (Pa), V - a gáz mennyisége (m 3), m - anyag tömege (g), M - moláris tömege anyag (g / mol) T - abszolút hőmérséklet (K), R - az univerzális gázállandó egyenlő 8,314 J / (mol × K).
Példák problémák megoldása
Nitrogén nyerhető hőbontásával ammónium-nitrit:
Határozza meg, mely a gáz térfogata a normál feltételekre, által alkotott bomlása ammónium-nitrit tömege 16 g.
Az egyenlet a reakció:
Számítsuk ki a mennyisége az anyag ammónium-nitrit (moláris tömege egyenlő - 64,06 g / mol):
Szerint a reakció egyenlet n (NH4 NO2): n (N2) = 1: 1, azaz a n (NH4 NO2) = N (N2) = 0,25 mol. Mi térfogatának kiszámításához a kialakult nitrogén:
V (N2) = 0,25 × 22,4 = 5,6l.