Fémek és vegyületeik
Reakcióegyenletek fémek:
- a) egyszerű anyagok: oxigén, hidrogén, halogének, kén, nitrogén, szén-dioxid;
- b) összetett anyagok: víz, savak, lúgok, sók.
- K s-fémek közé csoportjának elemeiből I és II, minden elemét s-és p-csoportbeli elem III (kivéve bór), valamint ón és az ólom (IV-csoport), bizmut (V sáv) és a polónium (VI-csoport). Fémek többnyire a külső elektron energiaszint 1-3. Az atomok d-elemek belül időszakok balról jobbra van töltve d-sublevels predvneshnego réteget.
- Kémiai tulajdonságait fémek miatt jellegzetes szerkezete a külső elektronikus kagyló.
Az időszakon belül a növekvő költség mag sugarak atomok az azonos számú elektron héj csökken. A legnagyobb sugara van alkálifém atom. A kisebb atomi sugár, nagyobb a ionizációs energia és a nagyobb az atomi sugara, annál kisebb a ionizációs energia. Mivel a fém atomok a legnagyobb sugara atomok, ezek jellemzik elsősorban alacsony értékeket az ionizációs energia és elektron-affinitása. Szabad fémek mutatnak rendkívül csökkentő tulajdonságokkal.
3) fémek képeznek oxidok, például:
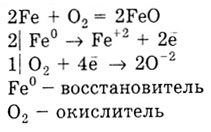
Ez reagál a hidrogén csak alkáli- és alkáliföldfémek alakítás hidridek:
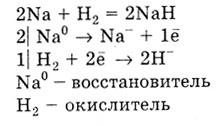
Fémek reagálnak halogénekkel képező halogenidek kén - szulfidok, a nitrogén - nitridek, szén - karbid.


A növekedés az algebrai értékeinek standardpotenciál E 0 a fém az elektrokémiai sorban a fém a vízzel reagálva csökken. Így a vas reakcióba lép a vízzel csak nagyon magas hőmérsékleten:

Fémek pozitív standardpotenciál, azaz állva után hidrogént az elektrokémiai sorban, nem reagálnak a vízzel.
Jellemző fémek reakció savakkal. Fémek egy negatív értékkel E 0 kiszorítják hidrogént Sósavoldat, H 2 S0 4 H 3 P0 4, és a hasonlók. D.
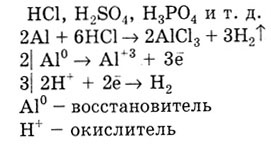
A fém az alsó E0 kiszorítja fém egy nagy értékű E 0 só oldatok:
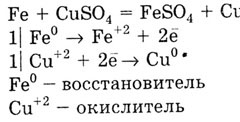
Kritikus kalcium kapott vegyület az iparban, a kémiai tulajdonságok és módszerek segítségével állíthatók elő.
a) reakcióba lép a vízzel, hogy kiadja nagy mennyiségű hőt:
CaO + H 2 0 = Ca (OH) 2 (mészhidrát).
b) reagáltatunk egy savval, hogy egy só és a víz;
CaO + 2H + = Ca 2+ + H 2O
c) reagál savas oxidok sóképzésre:
Kalcium-hidroxid Ca (OH) 2-t alkalmazunk az oltott mész formájában, mésztej és mész víz.
Mésztej - szuszpenziót úgy képezzük, hogy összekeverünk egy feleslegben oltott mész vízzel.
Meszes vízzel - tiszta oldatot szűrésével kapott mésztej. A laboratóriumban használt kimutatására a szén-monoxid (IV).
A Ca (OH) 2 + CO 2 = CaCO 3 + H 2O
Hosszantartó halad a szén-monoxid (IV) pastvor átlátszóvá válik, mint képződött só oldódik vízben:
Ha az így kapott tiszta oldatot a kalcium-hidrogén-karbonát elegyét, ismét zavarosság lép fel, mert Falls SaS0 3 csapadék.